Lecanemab: Wie das Medikament bei Alzheimer wirkt und wer es ...

Die europäische Arzneimittel-Behörde EMA hat für die EU erstmals grünes Licht für eine Alzheimer-Therapie gegeben, die auf zugrundeliegende Krankheitsprozesse abzielt. Die Behörde empfahl die Zulassung des Antikörpers Lecanemab zur Behandlung von leichter kognitiver Beeinträchtigung (Gedächtnis- und Denkstörungen) oder leichter Demenz in einem frühen Stadium der Alzheimer-Krankheit. Vor vier Monaten hatte sich die EMA noch gegen eine Zulassungs-Empfehlung ausgesprochen.
Bisherige Alzheimer-Therapien behandeln nur Symptome der Krankheit, nicht ursächliche Prozesse im Gehirn. Bei der EMA-Empfehlung gibt es allerdings eine Einschränkung: Das Mittel solle nur für Alzheimer-Patienten verwendet werden, die nur eine oder keine Kopie von ApoE4, einer bestimmten Form des Gens für das Protein Apolipoprotein E, haben. Bei ihnen ist die Wahrscheinlichkeit für bestimmte schwerwiegende Nebenwirkungen – Schwellungen und Blutungen im Gehirn – geringer als bei Menschen mit zwei ApoE4-Kopien.
Lecanemab: Zulassung im Juli noch abgelehntDie für die Zulassung zuständige EU-Kommission folgt gewöhnlich dem Votum der EMA. Hersteller von Lecanemab sind die Pharmaunternehmen Eisai (Japan) und Biogen (USA). Im Juli hatte die EU-Arzneimittelbehörde eine Zulassung noch abgelehnt: Das Risiko schwerer Nebenwirkungen des Antikörpers sei höher zu bewerten als die erwartete positive Wirkung, hieß es. Die Hersteller hatten eine zweite Prüfung beantragt.

Der Humanarzneimittelausschuss (CHMP) der EMA kam nun zu dem Schluss, dass in der begrenzten Population, die bei der erneuten Prüfung untersucht wurde, der Nutzen von Lecanemab bei der Verlangsamung des Fortschreitens der Krankheitssymptome größer ist als die Risiken. Bei der ersten Prüfung waren noch keine Untergruppenanalysen berücksichtigt worden, sondern alle Patienten.
Nebenwirkungen von Lecanemab in Untergruppe seltenerBei den mit Lecanemab behandelten Patienten mit nur einer oder keiner ApoE4-Kopie traten demnach bei 8,9 Prozent Ödeme auf, im Mittel aller Patienten bei 12,6 Prozent. Mikroblutungen gab es bei 12,9 Prozent der Patienten mit nur einer oder keiner ApoE4-Kopie, verglichen mit 16,9 Prozent der breiteren Population. Bei den Patienten mit nur einer oder keiner ApoE4-Kopie, die mit Placebo (einer Scheinbehandlung) behandelt wurden, lagen die Werte für Schwellungen bei 1,3 Prozent und für Blutungen bei 6,8 Prozent, wie es von der EMA hieß.
Hauptmaßstab für die Wirksamkeit war die Veränderung der kognitiven und funktionellen Symptome nach 18 Monaten, die anhand einer Demenzbewertungsskala (CDR-SB) gemessen wurde. Die Skala reicht von 0 bis 18, wobei höhere Punktzahlen eine stärkere Beeinträchtigung anzeigen. Mit Lecanemab behandelte Patienten wiesen nach 18 Monaten im Mittel einen etwas geringeren Anstieg des Wertes auf (1,22 gegenüber 1,75). Das deute auf einen langsameren kognitiven Abbau hin, teilte die EMA mit.
Regelmäßige Kontrollen bei Behandlung mit Lecanemab nötigDie Behörde betont in ihrer Stellungnahme, dass es zwingend Maßnahmen zur Risikominimierung geben müsse. Vor Beginn der Behandlung und vor der 5., 7. und 14. Lecanemab -Dosis müssen bei den Patienten demnach MRT-Scans durchgeführt werden, zusätzliche Scans bei Warnzeichen wie Kopfschmerzen, Sehstörungen und Schwindel.
Der Antikörper, der seit Anfang 2023 bereits unter dem Handelsnamen Leqembi in den USA zugelassen ist, soll das Proteinfragment beta-Amyloid (Aß) aus dem Gehirn entfernen. „Amyloid ß steht vermutlich am Beginn einer Kaskade der neuronalen pathologischen Veränderungen im Gehirn“, sagte Jörg Schulz von der Uniklinik Aachen, Sprecher der Kommission „Demenz und Kognitive Störungen“ der Deutschen Gesellschaft für Neurologie (DGN).
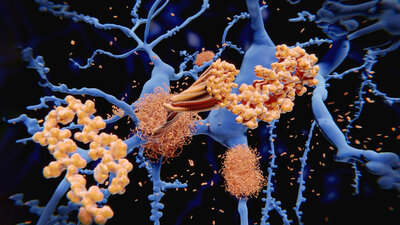
Wie Lecanemab im Gehirn wirktBei der Alzheimer-Krankheit kommt es zu krankhaften Ablagerungen im Gehirn. Als Auslöser gelten sogenannte Tau-Proteine, die sich in den Gehirnzellen bilden, und Beta-Amyloid-Plaques, die sich außerhalb der Nervenzellen ablagern. Diese Eiweiß-Ablagerungen stören die Funktion in und zwischen den Nervenzellen – die Zellen sterben nach und nach ab.
Der Antikörper Lecanemab richtet sich gezielt gegen das Protein Beta-Amyloid. „Das Lecanemab bindet sich an die Beta-Amyloid-Ablagerung. Und dann räumt das Immunsystem die markierten Amyloid-Ablagerungen ab“, erklärt Prof. Dr. Dorothee Saur, Neurologin am Universitätsklinikum Leipzig. „Durch die Behandlung verschwinden die Beta-Amyloid-Ablagerungen im Gehirn nahezu vollständig.“
Es steht jetzt also ein Medikament zur Verfügung, das gegen die Ursache von Alzheimer wirkt. „Damit haben wir sozusagen zum ersten Mal den Fuß in der Tür zur Behandlung der Alzheimer-Krankheit“, sagt Prof. Dr. Heinz Wiendl, Direktor der Klinik für Neurologie mit Institut für Translationale Neurologie am Universitätsklinikum Münster. „Wenn man das Beispiel des halb leeren oder vollen Glases bemüht, heißt das: Wir haben mit einem leeren Glas angefangen. Und jetzt haben wir zwei Schlucke darin und können zumindest einigen Patienten eine Behandlung anbieten.“
„Diese neue Entwicklung bedeutet einen großen Hoffnungsschimmer. Dennoch sollte man nicht denken: Jetzt haben wir Alzheimer geheilt. Dieses neue Therapie-Prinzip ist lediglich ein erster Schritt in diese Richtung“, sagt Wiendl.
Das Fortschreiten der Alzheimer-Krankheit kann mit dem neuen monoklonalen Antikörper nicht gestoppt oder rückgängig gemacht, sondern lediglich verlangsamt werden: In einer sogenannten Phase-3-Studie mit 1795 Probandinnen und Probanden konnte das Lecanemab den Krankheitsverlauf um etwa 30 Prozent verzögern. [1]„Für die Betroffenen kann das weitere Lebenszeit mit geringeren Einschränkungen bedeuten“, erklärt die Alzheimer-Expertin. „Allerdings ist der Effekt für die Betroffenen am größten, deren Hirnfunktionen noch überwiegend intakt sind. Sind bereits zu viele Nervenzellen abgestorben, sodass die Netzwerke im Gehirn Schaden genommen haben, kann man durch Beseitigung der Ablagerungen leider nicht mehr viel erreichen.“
Die Therapie mit dem Antikörper Lecanemab ist sehr aufwändig. Etwa alle zwei Wochen erhalten die Betroffenen Infusionen in der Klinik. Außerdem müssen sie regelmäßig – vor allem zu Beginn der Therapie – MRT-Kontrollen durchführen lassen. „Bislang sah man Alzheimer-Betroffene alle drei bis sechs Monate. Mit der neuen Therapie sind sehr viel häufiger ärztliche Kontakte notwendig“, sagt Prof. Wiendl. Einerseits, um früh mögliche Nebenwirkungen zu erkennen, aber auch, um die Wirksamkeit der Therapie zu überprüfen.
„Wir müssen jetzt erst einmal in der echten Welt Erfahrungen mit diesem Antikörper sammeln. Studienpopulationen sind zwar sehr aussagekräftig – aber es sind eben Studienpopulationen“, erklärt der Neurologe vom Universitätsklinikum Münster. „Im Alltag lässt sich der Therapieeffekt allerdings nicht so einfach nachweisen, weil wir keine Kontrollgruppe haben und nicht Symptome verbessern, sondern eine Verschlechterung eindämmen. Im individuellen Fall wissen wir also nie, wie viel wir eindämmen, wie schnell die Erkrankung ohne Medikament vorangeschritten wäre, und wie schnell wir den Verlauf beeinflussen können.“ Wie lange die Behandlung dauern soll, ist dementsprechend derzeit noch unklar und Gegenstand der Forschung.
Grundsätzlich gilt die Therapie als gut verträglich. Allerdings kam es in der genannten Studie bei 17 Prozent der Probandinnen und Probanden zu Hirnschwellungen, die in den meisten Fällen symptomlos verliefen. „Die Antikörper binden sich an das Beta-Amyloid. Dann kommt das Immunsystem und räumt es ab. Das heißt: Da läuft eine Entzündungsreaktion im Gehirn ab – und die kann auch überschießen“, erklärt die Alzheimer-Expertin.
Kommt es zu Hirnschwellungen, müssen die Betroffenen engmaschig kontrolliert werden und die Therapie pausiert werden oder sogar beendet werden. „Durch jede neue Therapie-Intervention lernen wir aber wieder etwas Neues über die Erkrankung. Wir lernen also auch, wenn Betroffene Nebenwirkungen entwickeln oder aus anderen Gründen nicht von der Therapie profitieren und daraus können dann wieder neue Ansätze entstehen“, erklärt Prof. Wiendl.
„Noch fehlen überall die räumlichen und personellen Strukturen für die Therapie“, sagt Prof. Saur vom Universitätsklinikum Leipzig. Zudem ist unklar, wie die Behandlung finanziert wird. Sobald der Wirkstoff zugelassen wurde, erstatten die Krankenkassen das Medikament, aber nicht das Drumherum: die Diagnosestellung, Durchführung der Therapie oder Kontrolluntersuchungen. „Dennoch würden wir versuchen, sofort zu starten und die nötigen Strukturen dann nach und nach weiter auszubauen. Wir haben sogar schon Gespräche mit Patienten geführt, die nur darauf warten, dass sie starten können“, sagt Saur. Auch viele andere Kliniken in Deutschland werden erste einmal so verfahren.
Lecanemab ist das erste Medikament, das auf die grundlegenden Mechanismen der Erkrankung einwirkt. „Aber nicht jede Therapie-Innovation transformiert gleich die ganze Erkrankung“, sagt Prof. Wiendl. „Bei der Multiplen Sklerose war es ähnlich. Zunächst konnte man die Krankheit gar nicht behandeln, gab lediglich zur Linderung Kortison. Und die Betroffenen sind trotzdem regelmäßig im Rollstuhl gelandet“, erinnert sich der Neurologe.
Dann kamen die ersten Medikamente auf den Markt, mit denen man die Schübe reduzieren konnte. „Und heute – etwa 25 Jahre später – können wir 80 Prozent der Patientinnen und Patienten kontrollieren. Das war ein Prozess. Auch da haben sich durch einen Door-Opener andere Firmen an das Thema getraut. Diesen Effekt erhoffe ich mir jetzt auch durch diesen neuen Antikörper.“
Dass es bald weitere Ansätze geben wird, diese Krankheit zu behandeln, davon ist auch Prof. Saur vom Universitätsklinikum Leipzig überzeugt: „Das ist erst der Anfang. Aber es ist wirklich schön, zumindest einigen Betroffenen schon jetzt sagen zu können: Wir haben etwas, das Ihnen hilft.“

zum Artikel
zum Artikel
zum Artikel

















































